新闻资讯
新闻资讯
- 动态管式反应器小试中试产业化设备持液量是多少?持液量具体数据
- 微通道反应器小试中试产业化设备持液量分别是多少?
- 连续流工艺合成聚酯树脂,连续流技术合成聚酯树脂
- 微通道反应器怎么做到本质安全?微通道反应器安全优势
- 动态管式反应器有哪些优势?动态管式反应器优势
微化知识
- 动态管式反应器磁力耦合密封与双端面机械密封的区别
- 连续流技术再进化:段塞流如何开启化学实验“微观探索”新时代
- 告别烧瓶时代:微反应器让环加成反应走向工业化生产
- 当化学家遇上AI:光催化反应从此自动化?
- 连续流技术与高通量实验相结合,让化学研究效率显著提升
联系我们
手机:19314072625
电话:400-172-8090
邮箱:kxwlhg@163.com
地址:安徽省合肥市高新区永和路597号绿城科技园E栋6楼
微化知识
光催化连续流技术在药物合成领域的应用
- 作者:杨海军
- 发布时间:2023-07-14
- 点击:3903
近二十年来,随着连续流化学技术的不断进步,其在光化学合成领域得到广泛应用。光催化连续流反应器是该技术的核心部件,其脱胎于“芯片实验室”领域,截至目前已有许多关于连续流光化学反应器的报道。实验研究表明,绝大多数的光化学反应可以在连续流反应器中得到更高的转化率和选择性,并且比同类间歇式反应器具有更少的副反应。但是普通市售的汞灯、氙灯以及卤素灯波长分布发散,使得我们将目光转向了波长更加精确的LED光。由其组成的紧凑型LED阵列在连续流光化学合成中更加合适和高效,也为我们连续流光反应器设计提供了思路和方向。随着连续流光化学反应器的进一步发展,这一新技术的应用面越来越广,比如目前在有机合成领域中筛选不同的光反应条件,在药物合成领域中对新药物的发现,在量子领域中对于放射波的研究等。

从2005年连续流光化学反应器被提出并设计以来,已经有无数的试验成功案例。如:Booker-Milburn和Berry的FEP连续流光化学反应器已经证明,批次反应可以在连续流动中从几克放大到每天500g以上。Seeberger和Lévesque利用连续流光化学反应器每天生产200克以上的青蒿素。相关设计最近表明,光催化可以在具有高生产率的宏流装置或者称为大的连续流光化学反应器中进行,这是一个非常重要的发展。因为光催化是合成化学的一个强大的新兴领域,并有望得到广泛的应用。所有管道,玻璃器皿,灯和泵都可以以非常经济的价格在市场上购买,并且可以在标准通风橱中在几个小时内安装一个功能正常的反应器。在设计光催化反应器时我们要考虑到反应器的透光性、光的波长和溶剂的吸光度:
不同反应器材质的透光性
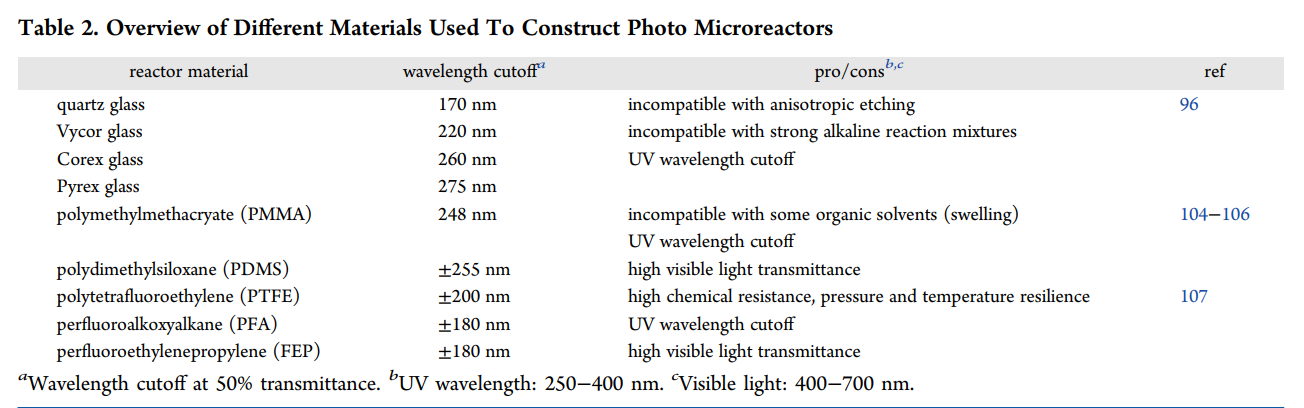
和普通硅酸盐玻璃相比,透明石英玻璃在整个波长有优良的透过性能。在红外区光谱透过比普通玻璃大;在可见区,石英玻璃的透过率也是比较高的。在紫外光谱区特别是在短波紫外区,光谱透过比其他玻璃好的多。光谱透过率受三个因素影响:反射,散射和吸收。石英玻璃的反射一般为8%,紫外区大一些,红外区小一些。所以石英玻璃的透过率一般不大于92%。石英玻璃的散射比较小,一般可以忽略。光谱吸收和石英玻璃的杂质含量和生产工艺有密切的关系;在低于200nm波段的透过率的高低,代表金属杂质含量的多少;240nm的吸收表示缺氧结构的多少;可见波段的吸收是由于过渡金属离子的存在造成的。综合成本、压力和透光性对于光催化连续流反应也可以选择PFA或FEP材质来替代石英。
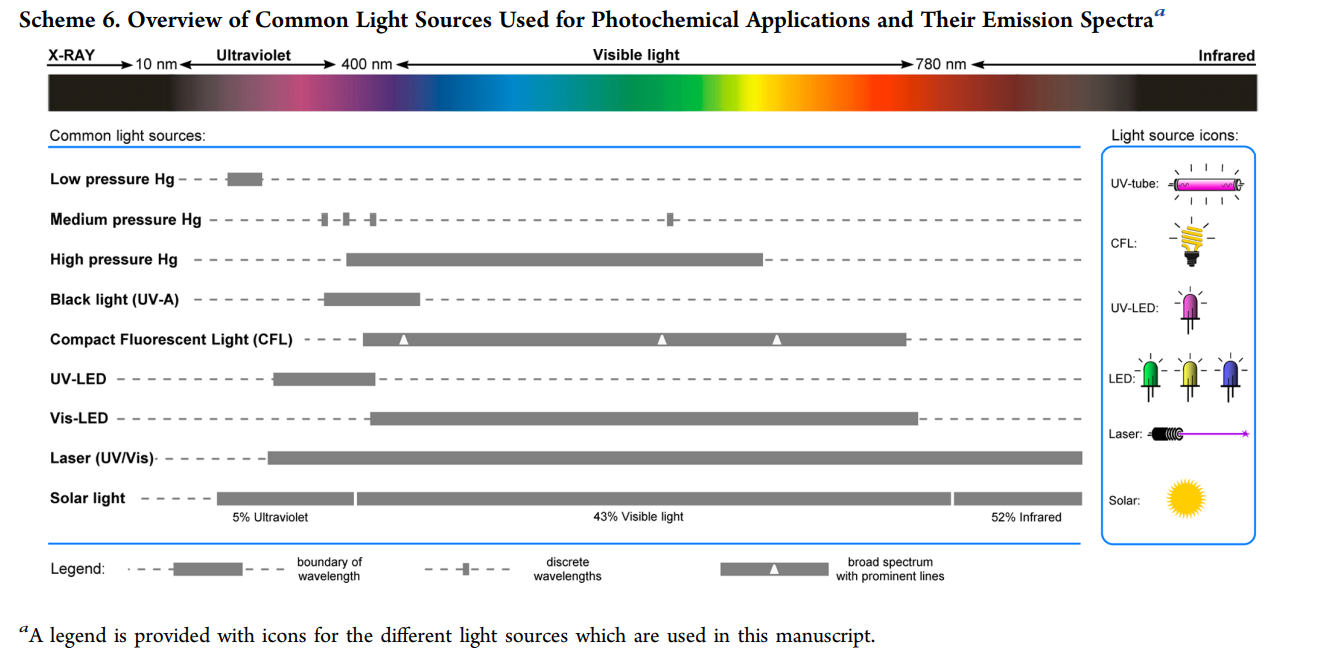
不同光源的波长范围
不同溶剂的截止波长
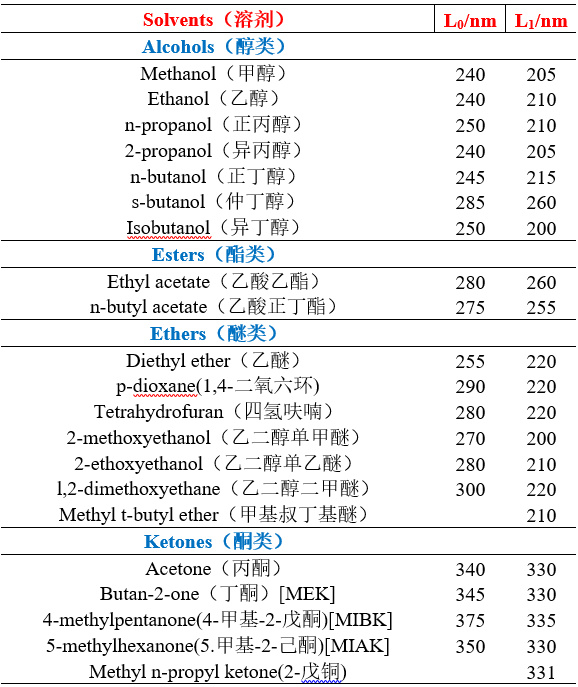
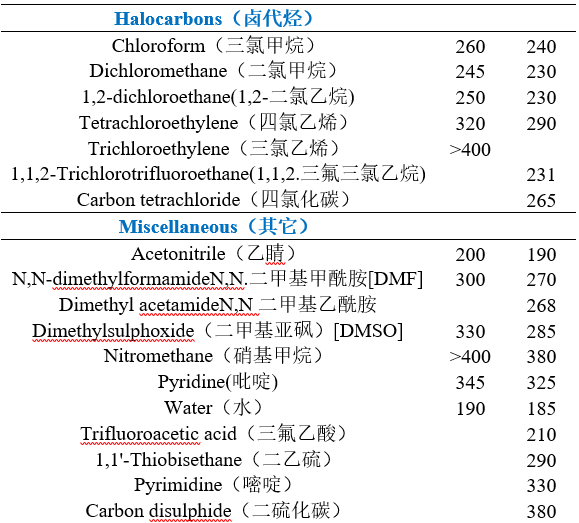
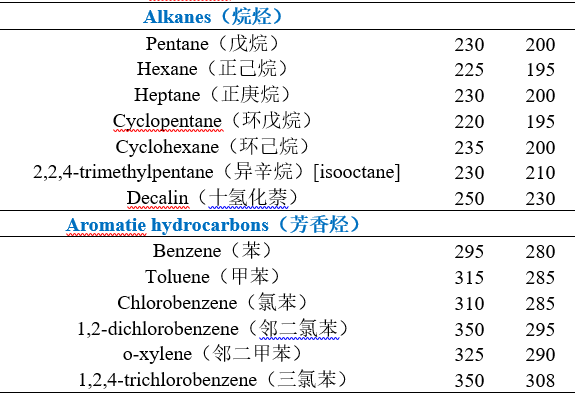
注:
1.低于上表中近似波长(nm)的溶剂吸收,不可采用。对于定量分析,可将L0作为截止波长,此时溶剂吸光度(10mm光程)相对于水应超出0.05个单元,即A 1cm > 0.05。对于定性分析,可将较低波长L1作为截止波长,即A 1cm > 1.0
2.溶剂的紫外截止波长:指当小于截止波长的辐射通过溶剂时,溶剂对此辐射产生强烈吸收,此时溶剂被看作是光学不透明的,它严重干扰组分的吸收测量。
3.测量方法:将溶剂装入1cm的比色皿,以空气为参比,逐渐降低入射波长,溶剂的吸光度A=1时的波长称为溶剂的截止波长,也称极限波长。
以下是利用光催化连续流技术实现的几个典型药物:
1.布洛芬的合成
布洛芬( Ibuprofen )是一种可以在连续流动条件下或光化学条件下制备的原料药。基于Baxendale及其合作者的方法[1],该化合物可以在连续流光化学条件下简单制备。该合成(图1)是基于氯代苯丙酮(2)的photo-Favorskii重排法,用市售的盘管流动系统进行反应。评价不同的反应条件,如停留时间( 7.5、10、15、20、30、40 min)、浓度( 0.08、0.1和0.12 vol %)、反应器温度( 20、30、55、65、70、75 °C)和80 W中压汞灯,同时测试不同滤光片( I-V )的功率设定( 80 %、90 %和100 %) ( 220 ~ 600 nm),得到不同的发射光谱。确定了在浓度为0.1 %,65 °C下80 %光照20 min,以0.5 mL / min的流速可以生成76 %产率的布洛芬(生产率2.52 mmol / h)[2]
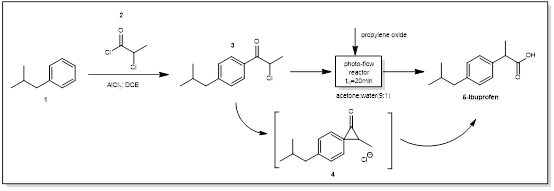
图1 布洛芬光催化合成路线
2.金丝桃素的合成
金丝桃素(Hypericin)是一种天然存在于金丝桃属植物中的萘并二蒽酮,俗称圣约翰草[3]。金丝桃素具有广泛的药理学应用,其中抗抑郁、抗病毒、抗炎和抗肿瘤等活性已被发现[4-6]。然而,在大量和纯净的状态下直接从工厂获得金丝桃素需要很高的商业成本。为了克服这一限制,人们提出了不同的合成路线[7-10]。Steglish等[11]的首次合成是将大黄素(6)用碱和对苯二酚处理3周进行还原偶联,得到photo金丝桃素(7),再经太阳光照射得到金丝桃素,收率为29 %。接下来的工作涉及一个500 W的卤素灯( 588 nm ),经过长时间的照射(过夜)后,在批次设置中获得了63 %的金丝桃素[12]
在之后的工作中(图2),在光化学步骤中使用高功率(400 ~ 1000 W)和多频率光源[10,13,14]。使用发光二极管( LEDs ; 504 nm)作为光源可以显著提高金丝桃素的产率。在125 mL / s的流速下,在5.1 min的反应时间(生产率: 4.85 g / 5 min)内,以高达98 %的产率得到金丝桃素[15]
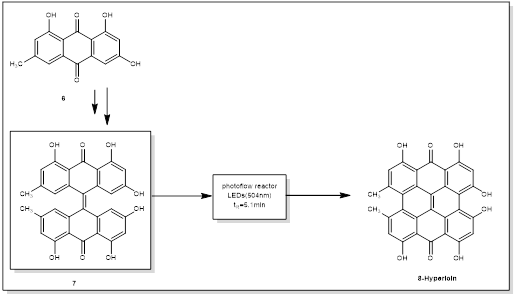
图2 金丝桃素光催化合成路线
3.新斯替宁碱的合成
据报道,Stemona生物碱,如新斯替宁碱,具有杀虫、驱虫和镇咳活性,可防治柠檬酸引起的咳嗽和各种神经化学反应[16]。新斯替宁碱11合成的关键步骤是[ 5 + 2 ]光环加成构建吡咯[ 1 , 2-α]azepine母核。该反应由Booker Millburn小组在[17,18]批次中使用125 W中压汞灯( 300 nm )进行初步测试。这种特别敏感的反应可以在100 mL的浸没式间歇光反应器中进行50 mg的规模,产率为40 % ~ 60 %。当放大到> 100 mg时产率下降到20 %以下。鉴于此,反应在包裹在Pyrex浸没井周围的含氟乙烯丙烯( FEP )管中的流动条件下(图3)进行。在10 mL体积反应器中用400 W的Hg灯照射溶液,流速为11 mL / min,可以分离63 %和回收20 %的原料[19]。这使得在单次9 h运行(生产能力: 144 mg / h)中合成1.3 g的光加成产物成为可能。而要达到这个物质的量,需要超过42个单独的批次反应。
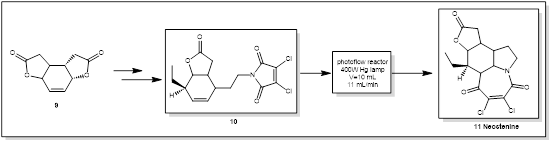
图3 新斯替宁碱光催化合成路线
4.哌啶的N-甲酰化反应
胺的N-甲酰化反应是一类重要的有机合成反应,通常使用价格相对昂贵或不容易获得的金属催化剂,需要苛刻的条件来提高反应效率。Xu等人于2023年,开发了一种高效的连续流哌啶的气液可见光催化N-甲酰化反应,在温和的反应条件下,使用廉价的有机染料光催化剂,在12 min内实现了82.97 %的反应产率和> 99 %的选择性[20]。
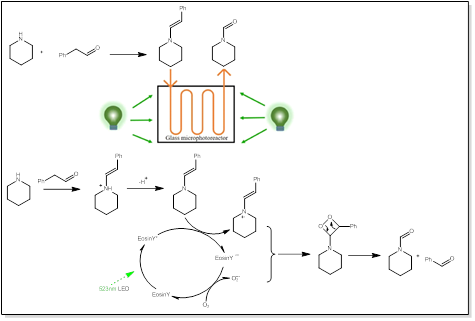
图4 哌啶的N-甲酰化光催化合成路线
5.芳香醛的双官能团构建
据报道,将各种芳香醛转化为β-酮腈及其相关衍生物种的光催化反应是一个较为温和的过程。将四丁基铵十聚钨酸盐( TBADT )作为光催化剂与365nm大功率LED相结合。通过将LED光源集成在外壳式反应器线圈内的流动反应器平台,实现了标准化和可扩展性。Cruise等人于2023年,在不断优化反应条件下,实现多种芳香醛和杂芳香醛与丙烯腈、甲基丙烯酸甲酯和苯基乙烯砜反应,得到产率高、停留时间短( 5 ~ 30 min )、处理量高达41 mmol / h的目标产物。对于反应性较低的醛类,观察到低聚杂质,但可以通过降低反应混合物的浓度来抑制。并尝试了一种利用静态混合器线圈在空气存在下淬灭激发光催化剂的新方法,该方法克服了收集容器中反应不受控制的问题。这种连续化的过程克服了之前芳香性底物所遇到的限制,并且实现一种有效的手段来生成各种双官能团模块[21]。
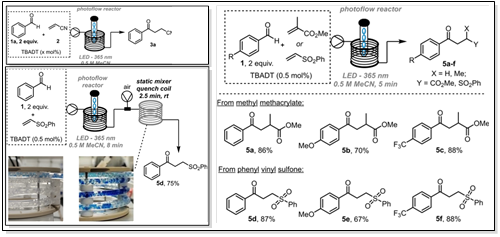
图5 芳香醛的双官能团构建光催化合成路线
6. Goniofufurone
( + ) - Goniofufurone是从植物家族番荔科[22]的哥纳香树中分离得到的一种含有天然产物的独脚金内酯。此类植物提取物已被用作治疗水肿和风湿病。它的衍生物对许多人类细胞具有很强的抗增殖作用[23]。Booker - Milburn [24]从对映烯醇醚(69)出发,仅用5步就实现了( + ) -Goniofufurone (73)短而可扩展的合成方法(图6)。其关键特征包括通过光催化Paternò–Büchi反应形成氧杂环。将四氢呋喃[ 3 , 2 - b]呋喃- 3 -基乙酸酯(70)用400 W中压汞灯( 365 nm )在间歇浸没井中照射,得到了所需的氧杂环丁烷72和结构异构体71的2:1,溶液是不可分离混合物。尽管产物以90 %的产率得到,但是该反应是很缓慢的( 24 h运行,生产率0.46 g / h),需要在高稀释度( 0.03 M )下运行。这意味着,在一个批次中进行有意义的放大是相当有限的。通过使用三层氟化乙烯丙烯( FEP )流动光反应器和400 W中压灯克服了这一步骤的批量限制。这使得在单次运行83 h( 1 mL / min ,停留时间70 min)中,可以合成> 40 g的中间体(产率93 % )。
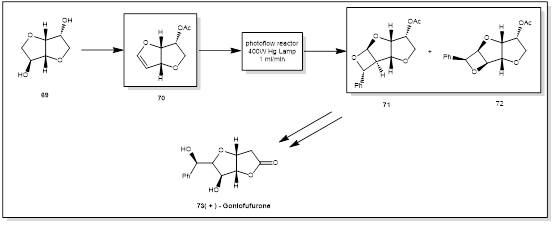
图6 Goniofufurone光催化合成路线
7. 驱蛔素
驱蛔素(Ascaridol)是一种双环单萜,含有桥连过氧化物官能团,具有驱虫[25]、镇静镇痛和抗真菌作用[26]。驱蛔素在体外也表现出对不同肿瘤细胞的活性产生影响[27]。Rose Bengal作为光敏剂被用于驱蛔素(75)的合成[28]。该合成可在装有20 W钨灯的微芯片反应器中进行,在550 nm (流速: 1μL / min)下,向α -萜品烯(74)中加入单线态氧(图7)。利用了其小的长度尺度和高的表面积体积比使得反应器占地面积最小化。此外,由于微芯片的通道深度约为50 μm,辐射很容易穿透整个反应。在100 mL反应瓶中用500 W的钨灯照射4 h,将该微流反应与间歇式反应器进行比较,发现虽然微流反应提供了较高的产率( 85 % vs 67 %),但反应器的产率明显低( 1.5 mg / h vs 175 mg / h)。这突出了向微流光化学转移的一个共同问题:尽管产量可能会增加,但由于微芯片反应器的容量,生产率可能会显著降低。这可以通过使用多重并行的方法来克服[29]。
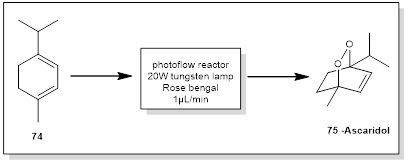
图7 驱蛔素光催化合成路线
8. 氟维司群
氟维司群(Fulvestrant)是一种用于乳腺癌治疗的化疗药物[30],它含有由五氟-1-醇(78)经五氟-2-碘戊烷-1-醇(77)脱卤化而成的全氟化侧链。中间体五氟-2-碘戊烷-1-醇的制备(图8)的光化学步骤[31]是以丙烯醇(73)和三乙胺(Et3N)为原料,以LED为光源(405 nm),在20℃下停留20min(流量:1mL/min)进行的,产物收率为87%。在不到1分钟的停留时间(50℃,20bar)内,观察到77完全转化为脱碘产物78,三步得率为73%(产率:7.6g/h)。五氟-1-醇是氟维斯特(79)的理想侧链。在弗维斯特商业开发期间,中间体五氟-1-醇78的供应和成本被认为是主要问题,这突显了需要一种可扩展的合成,如这种连续流动方法[32]。
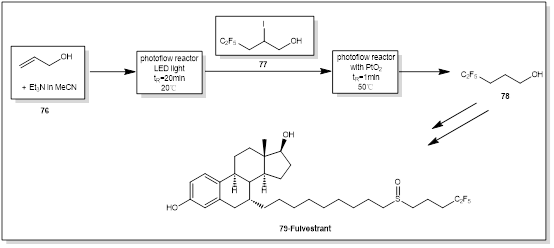
图8 氟维司群光催化合成路线
随着连续流光化学反应技术的普及和发展,科芯微流希望整个有机合成领域能够更多地参与到连续流光化学反应技术大楼的搭建,并将其应用于解决一般的合成问题。在此提出:您的化学合成能否让您能够高效、绿色、安全的实现百克/日乃至公斤/日的具有复杂结构的分子?光催化连续流技术可以!
[1] Baumann, M.; Baxendale, I.R. Continuous Photochemistry: The flow synthesis of Ibuprofen via a Photo-Favorskii rearrangement. React. Chem. Eng. 2016, 1, 147.
[2] Politano, F.; Oksdath-Mansila, G. Light on the horizon: Current research and future perspective of flow-photochemistry. Org. Process Res. Dev. 2018, 22, 1045.
[3] Karioti, A.; Bilia, A.R. Hypericins as Potential Leads for New Therapeutics. Int. J. Mol. Sci. 2010, 2, 562.
[4] Joniova, J.; Rebic, M.; Strejckova, A.; Huntosova, V.; Stanicova, J.; Jancura, D.; Miskovsky, P.; Bano, G. Formation of large Hypericin aggregates in giant unilamellar vesicles – experiments and modeling. Biophys J. 2017, 112, 966.
[5] Do, M.H.; Kim, S.Y. Hypericin, a Naphthodianthrone derivative, prevents methylglyoxal-induced human endothelial cell dysfunction. Biomol. Ther. 2017, 25, 158.
[6] Huntosova, V.; Novotova, M.; Nichtova, Z.; Balogová, L.; Maslankova, M.; Petrovajova, D.; Stroffekova, K. Assessing lightindependent effects of hypericin on cell viability, ultrastructure and metabolism in human glioma and endothelial cells. Toxicol. Vitro. 2017, 40, 184.
[7] Brockmann, H. Carotinoide von P. Karrer und E. Jucker, Lehrbücher und Monographien aud dem Gebiete der exakten Wissenschaften, Chemische Reihe Band III. Verlag Birkhäuser, Basel 1948. 388 S. 28 Bilder. Preis broschiert 39.–Fr., geb. 43.– Fr. Angew. Chem. 1949, 61, 389.
[8] Brockmann, H.; Eggers, H. Partial synthese von photo-hypericin und Hypericin aus Penicilliopsin. Chem. Ber. 1958, 91, 81.
[9] Aigner, S.; Falk, H. A microwave-assisted synthesis of phenanthroperylene quinones as exemplified with hypericin. Monatsh. Chem. 2008, 139, 991.
[10] Huang, L.F.; Wang, Z.H.; Chen, S.L. Hypericin: Chemical synthesis and biosynthesis. Chin. J. Nat. Med. 2014, 12, 81.
[11] Steglich, W.; Arnold, R. Synthesis of Hypericin and Related meso-Naphthodianthrones by Alkaline Dimerization of Hydroxyanthraquinones. Angew. Chem. Int. Ed. Engl. 1973, 12, 79.
[12] Mazur, Y.; Bock, H.; Lavie, D. Preparation of Hypericin. US Patent 5,120,412A, 9 June 1992.
[13] Falk, H.; Schoppel, G. On the synthesis of hypericin by oxidative trimethylemodin anthrone and emodin anthrone dimerization: Isohypericin. Monatsh. Chem. 1992, 123, 931.
[14] Gruszecka-Kowalik, E.; Zalkow, L.H. An improved synthesis of Hypericin and related compounds. Org. Prep. Proced. Int. 2000, 32, 57.
[15] Goncalves, R.S.; Rabello, B.R.; César, G.B.; Periera, P.C.S.; Ribeiro, M.A.S.; Meurer, E.C.; Hioka, N.; Nakamura, C.V.; Bruschi, M.L.; Caetano, W. An efficient multigram synthesis of Hypericin improved by a low powered LED based photoreactor. Org. Process Res. Dev. 2017, 21, 2025.
[16] Frankowski, K.I.; Setola, V.; Evans, J.M.; Neuenswander, B.; Roth, B.L.; Aubé, J. Synthesis and receptor profiling of Stemona alkaloid analogues reveal a potent class of sigma ligands. PNAS 2011, 108, 6727.
[17] Hook, B.D.A.; Dohle, W.; Hirst, P.R.; Pickworth, M.; Berry, M.B.; Booker-Milburn, K.I. A practical flow reactor for continuous organic photochemistry. J. Org. Chem. 2005, 70, 7558.
[18] Lainchbury, M.D.; Medley, M.I.; Taylor, P.M.; Hirst, P.; Dohle, W.; Booker-Milburn, K.I. A Protecting Group Free Synthesis of (±)-Neostenine via the [5+2] Photocycloaddition of Maleimides. J. Org. Chem. 2008, 73, 6497.
[19] Cambié, D.; Bottecchia, C.; Straathof, N.J.; Hessel, V.; Noel, T. Applications of continuous-flow photochemistry in organic synthesis, material science, and water treatment. Chem. Rev. 2016, 116, 10276.
[20] Xu, Y.; Zhao, F.; Guo, X. Continuous microflow visible-light photocatalytic N-formylation of piperidine and its kinetic study. Chinese Chemical Letters 2023, 108642.
[21] Cruise, A.; Baumann, M. TBADT‐Mediated C‐C Bond Formation Exploiting Aryl Aldehydes in a Photochemical Flow Reactor. ChemCatChem 2023, 15.
[22] Tuchinda, P.; Munyoo, B.; Pohmakotr, M.; Thinapong, P.; Sophasan, S.; Santisuk, T.; Reutrakul, V. Cytotoxic Styryl-Lactones from the Leaves and Twigs of Polyalthia crassa. J. Nat. Prod. 2006, 12, 1728.
[23] Popsavin, V.; Sreco, B.; Benedecovic, G.; Francuz, J.; Popsavin, M.; Kojic, V.; Bogdanovic, G. Design, synthesis and antiproliferative activity of styryl lactones related to (+)-goniofufurone. Eur. J. Med. Chem. 2010, 45, 2876.
[24] Michael, R.; Ng, S.; Booker-Milburn, K.I. Short flow-photochemistry enabled synthesis of the cytotoxic lactone (+)-Goniofufurone. Org. Lett. 2016, 18, 968.
[25] Dembitsky, V.; Shkrob, I.; Hanus, L.O. Ascaridole and related peroxides from the genus Chenopodium. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czechoslov. Repub. 2008, 2, 209.
[26] Pare, P.W.; Zajicek, J.; Ferracini, V.L.; Melo, I.S. Antifungal terpenoids from Chenopodium ambrosioides. Biochem. Syst. Ecol. 1993, 21, 649.
[27] Efferth, T.; Olbrich, A.; Sauerbrey, A.; Ross, D.D.; Gebhart, E.; Neugebauer, M. Activity of Ascaridol from the anthelmintic herb Chenopodium anthelminticum L. against sensitive and multidrug-resistant tumor cells. Anticancer Res. 2002, 22C, 4221.
[28] Wootton, R.C.R.; Fortt, R.; de Mello, A.J. A Microfabricated Nanoreactor for Safe, Continuous Generation and Use of Singlet Oxygen. Org. Process Res. Dev. 2002, 6, 187.
[29] Knowles, J.P.; Elliott, L.D.; Booker-Milburn, K.I. Flow photochemistry: Old light through new windows. Beilstein J. Org. Chem. 2012, 8, 2025.
[30] Bundred, N.; Howell, A. Fulvestrant (Faslodex[trademark]): Current status in the therapy of breast cancer. Expert Rev. Anticancer Ther. 2002, 2, 151.
[31] Rosso, C.; Williams, J.D.; Filippini, G.; Prato, M.; Kappe, C.O. Visible-light mediated Iodoperfluoroalkylation of alkenes in flow and its application to the synthesis of a key Fulvestrant intermediate. Org. Lett. 2019, 21, 5341.
[32] Brazier, E.J.; Hogan, P.J.; Leung, C.W.; O ́Kearney-McMullan, A.; Norton, A.K.; Powell, L.; Robinson, G.E.; Williams, E.G. Fulvestrant: From the Laboratory to Commercial-Scale Manufacture. Org. Process. Res. Dev. 2010, 14, 544.








 客服QQ
客服QQ