新闻资讯
新闻资讯
- 微通道反应器放大难点有哪些?微通道反应器放大困难分析
- 微通道反应器流道结构怎么选?选择微通道反应器流道结构的考量因素
- 合成二甲亚砜的方法,连续流反应器合成DMSO
- 连续流工艺合成维生素D2和维生素D3,连续流技术制备维生素D2和维生素D3
- 微通道反应器流道形状有哪些?微通道反应器流道形状样式
联系我们
手机:19314072625
电话:400-172-8090
邮箱:kxwlhg@163.com
地址:安徽省合肥市高新区永和路597号绿城科技园E栋6楼
微化知识
芳环亲电取代的见解
- 作者:杨海军
- 发布时间:2024-04-12
- 点击:3255
在化学合成中,很多芳香化合物及其衍生物的合成存在很多问题和挑战。为了使得产品具有独特的化学性质,需要向芳环上添加各式各样的取代基团。从电子理论出发,化学反应的本质是电子的迁移和耦合,芳环是一个特殊的结构,他的电子云相互重叠组成共轭结构,其化学性质则由整体共轭结构所决定。例如:苯环(包括其它芳环)上若事先已经连接了其他基团,则这个基团会对后继的亲电取代反应造成明显的影响。下图是常规取代基取代苯环后的各位点的电子云密度:
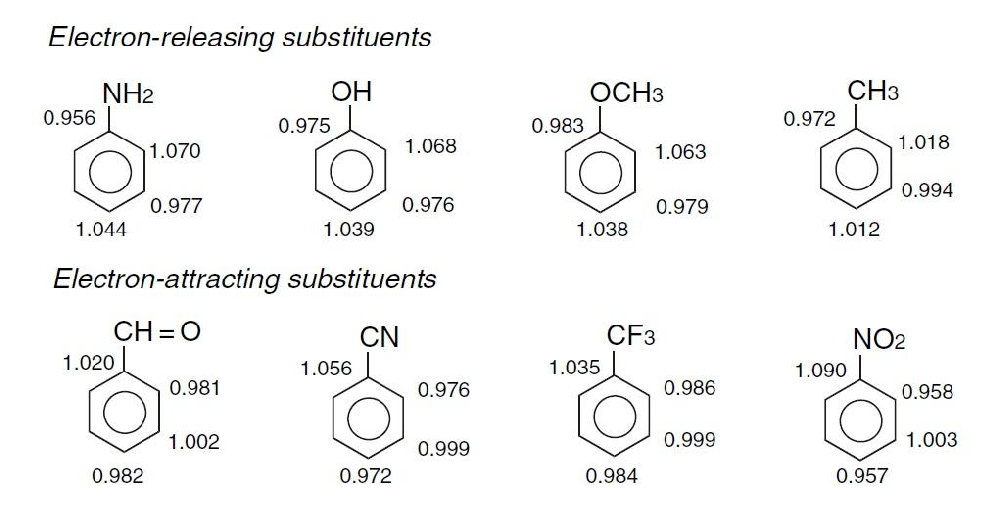
由图可知我们可将取代基大致分为两类:致活取代基和致钝取代基,两类取代基又将对后续的其他取代基的加入产生如下影响:
①对后继亲电取代反应速率的影响:此基团存在时,反应速率比没有此取代基更快(致活)还是更慢(致钝)
②对后继亲电取代位置的影响:主要发生在此基团的邻对位(邻对位定位基)还是间位(间位定位基)。
从反应机理的角度,我们实际可以通过如下原则判断特定基团这两方面的效应:活性效应:(反应前)基团使得苯环上电子云密度发生了怎样的变化,升高抑或降低?定位效应:(反应中)基团对邻、间、对位取代后各自生成的正离子中间体稳定性如何?注意,这里决定活性与定位这两种效应的时机不同,前者主要看反应前的底物分子,后者主要与反应中生成的正离子中间体有关。以下我们对这两种效应分别进行讨论。
1.对活性的影响:
已有基团对后继亲电反应活性的影响其实很简单。注意到我们接下来要发生的是亲电取代,进攻试剂缺电子,奔着芳环上较高密度的电子云过来,因此我们也很容易想象,若既有基团推电子,能使芳环电子云密度进一步升高,则后继反应速率上升,该基团致活;反之若既有基团吸电子,使得芳环电子云密度下降,则将增大后继反应的困难,该基团致钝。归根结底,还是看基团的电性效应。而我们知道一个基团的电性效应又分为诱导、共轭两个方面。基团连接在芳环旁侧时,通常总会有诱导效应。某些基团原子又有垂直于芳环的p轨道,也能与芳环形成共轭,则同样会具有共轭效应。考查给/吸电子能力时,我们经常需要综合考虑I/C这两方面的影响。
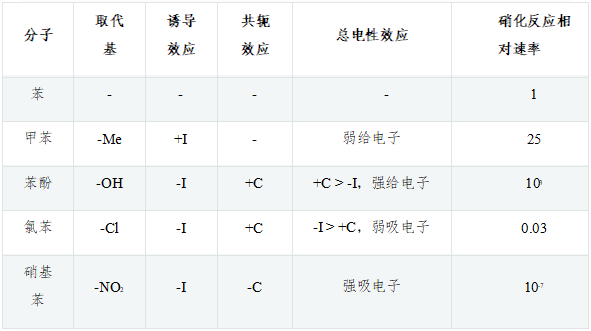
如下图,苯及其一系列单取代衍生物进行硝化反应,相同条件下若以苯的反应速率为基准,则甲苯、苯酚速率均较苯高而氯苯、硝基苯均较苯为低:
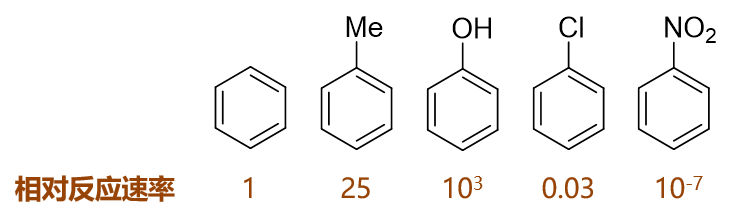
这些单取代苯反应活性上呈现出明显的区别,毫无疑问,与取代基团的电性效应直接相关,以下具体分析。
甲苯:作为烷基,甲基明显具有给电子诱导效应+I。而甲基碳sp3杂化,与苯环间并无共轭,因而不存在共轭效应。总体电性效应上,甲苯中的甲基是个不太强的给电子基团(单纯通过诱导效应给/吸电子,通常强度都不会特别大),因而其反应速率稍高于苯。
苯酚:羟基与苯环直接相连。诱导效应上,O的电负性较高,明显吸电子(-I)。但同时需要留神,羟基O原子这里会采取sp2杂化,与苯环之间存在共轭,因此我们还需要考虑共轭效应。有机分子中,若经典结构式上原子直接连接单根双键(如C=O中的O),则该原子一般总会采取sp2杂化。此外,经典结构式中只连接单键的杂原子,很多情况下杂化形态也会是sp2。由于共轭形成电子离域体系后能够使整个分子能量下降,因此当此类杂原子与双键、芳环碳相邻时(如此例中的羟基O),一般也会采取sp2杂化状态,使自己的p轨道能够参与到共轭中去。对于O而言,外层6电子,采取sp2杂化后这六个电子的排布如下图所示,sp2杂化轨道中有两根轨道存在未成对电子,这两根刚好分别于氢及苯环上的碳原子形成两根σ键(也就是结构式中的O-C、O-H单键)。除此之外,还有两对孤对电子,其中sp2杂化轨道上的那对与O-C、O-H键共面,也就是与苯环共面,无法与苯环碳的p轨道侧面交叠。但未参与杂化的另有一对电子的p轨道,恰好垂直于sp2及苯环的平面,刚好与苯环碳的p轨道平行,能够侧面交叠参与到共轭中去。因此这儿氧原子两对孤对电子里只有一对能参与到共轭里去,如下图所示。
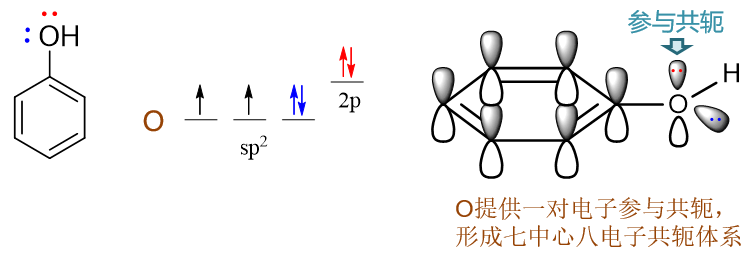
通常单个原子无法使自己的两根轨道同时处于平行状态,因而最多只能提供一根轨道参与共轭,共轭的电子数目不会超过两个。氧提供了两个共轭的π电子,而苯环上六个碳,我们很熟悉,每个碳一个π电子,凑到一块儿这七个原子总共会有八个电子形成共轭体系,也即 形成了Π78。粗略里看,每个原子差不多分到8/7个π电子。而氧参与共轭之前,如果光是苯环,明显是Π66,每个碳平均只有一个π电子。两相比较,在O参与共轭后,苯环的碳原子上电子云密度明显上升了,相当于O通过共轭作用,把自己的两个π电子推向了苯环。这其实也就是我们之前就已经了解的给电子共轭效应(+C)。
当前羟基氧的诱导、共轭效应刚好是相反的,一个吸电子一个给电子。在绝大多数场合下,共轭效应都是要强于诱导效应的, 而且往往是远强于(当然也有例外,我们马上就能看到)。因此两相叠加,整体上羟基连接在苯环旁侧时是个很强的给电子基团, 会使得苯环上亲电取代反应活性大大升高,不单强过单纯的苯环,甚至较甲苯的反应速率也高得多。电中性杂原子参与共轭时提供的p电子数目一般可依据如下原则计算:若其直接连接双键(如羰基C=O中的氧原子),此时形成的一般是π-π共轭,则一般提供一个π电子;若与其直接相连的仅有单键(如上例中的羟基氧),此时形成的一般是p-π共轭,则一般提供两个π电子。
氯苯:氯连接在苯环旁侧的效应与刚才的苯酚相仿。诱导明显还是吸电子,而共轭依然是给电子。Cl外层7个电子,采取sp2杂化 后的电子排布如下图所示,其中sp2杂化轨道上的未成对电子用来与苯环碳间形成单键,而也仅有未参与杂化的p轨道可以 加入共轭,提供一对电子,同样形成Π78共轭体系。
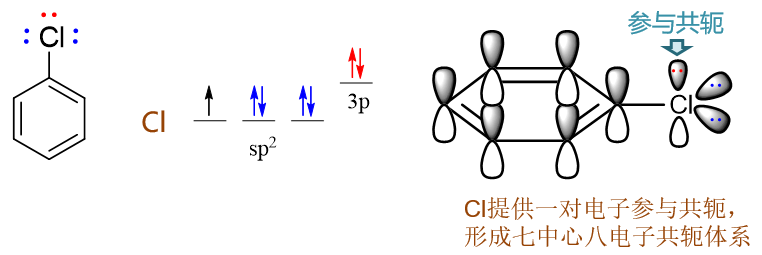
但与之前的氧相比,卤素原子电负性通常更强,当其与电中性的碳共轭体系(如这里的苯环)相连时,往往诱导效应要强于共轭效应。两相叠加,卤素原子这里总体上会体现出弱吸电子的特征。氯苯的亲电反应活性也就因之略低于苯。对绝大多数与碳原子相连的杂原子而言,如果存在共轭,则共轭效应强度会高于诱导效应。但与电中性碳相连的卤素是个例外。至于为什么要强调电中性碳,后面对定位效应的讨论中大家会进一步理解。
硝基苯:诱导效应依然容易分析,N、O电负性较高,明显-I。同时,硝基中的N、O原子实际也都采取sp2杂化,也能参与共轭。此处硝基与苯环共轭的情况较为复杂,我们只做 简明的讨论。硝基苯中硝基的结构基本如下图所示,它的经典结构式较为特殊,右侧一根N-O键上一对电子由N提供,而非正常共价键 一人出一个电子的模式。因此这里氧相当于多接受一个电子,带负电荷,而氮多提供一个电子,带正电荷(即所谓的“形式电荷”)。
既然是这么一个电子状态,明显硝基中N原子极度缺电子,具有强烈的从别处拉来电子的趋势,尤其与苯环共轭之后。我们知道共轭体系 π电子不是定域而是可以离域自由流动的,流动性非常高,当前N又特别能拉,电子云无疑会从苯环向氮原子处移动。也就是说,通过共轭,氮上电子云密度上升而苯环电子云密度下降了,因此这儿硝基将具有相当强的共轭吸电子效应-C。
诱导、共轭均吸电子,整体上硝基也是个极强的吸电子基团——在常见电中性基团中基本是最强的一个。这一组分子里,硝基苯自然反应活性最低。这组分子的电性效应、反应活性情况,归纳起来大致如下表所示。
除了这四种基团外,其它常见的芳环旁侧给/吸电子基团情况可见参底下这张大表,从上向下,总体上给电子能力渐弱吸电子能力渐强:
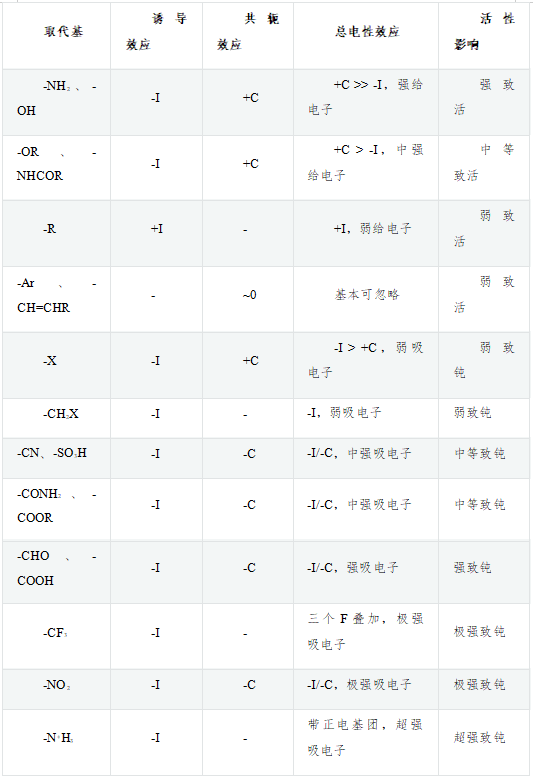
这里比较有趣的是表中第四行-Ar、-CH=CHR这样的基团,主体都是碳原子,也都采取sp2杂化,诱导效应基本可以忽略。与芳环共轭时,每个碳也都是出一个p电子,通常也不会使得芳环电子云密度上升(表中用~0标记)。既然其基本不影响芳环上的电子云密度,为何还是弱致活的基团呢?主要原因是它们可以扩大反应中间体的共轭体系,使得中间体稳定性上升进而使反应活化能下降。具体可参见下面定位效应中对反应中间体的讨论。
关于芳环旁侧基团共轭给/吸电子的判断,一般来说有如下规律:基团中原子提供2个电子参与共轭(典型如-NH2、-OH、-OR),提供的π电子数高于原本芳环的平均值(每原子1个),通常+C;含杂原子的基团中每原子平均提供1个电子参与共轭(典型如羰基-C=O,碳氧间π键一对电子与芳环共轭,碳氧两个原子平均一人一个),由于杂原子电负性的关系,共轭体系离域电子容易向杂原子一侧集中,通常-C;不含杂原子的基团中每原子平均提供1个电子参与共轭(典型如烯基-C=C),通常既无+C也无-C;基团中原子提供0个电子参与共轭(既仅有空的p轨道,硝基接近于此情形,但不完全一样),低于原本芳环的平均值,通常强烈的-C。
2.对定位的影响
既有基团对苯环上后继亲电取代反应的位置也有影响,一部分基团会使后继反应主要发生在自己邻对位,即所谓的邻对位定位基;而另一部分基团相反, 使后继反应主要发生在自己的间位,我们称为间位定位基。一般给电子的致活基团都是邻对位定位基,而吸电子的致钝基团大多数都是间位定位基,活性与定位之间似乎存在着明显的关联性。之所以如此,还是与反应机理有关。我们知道苯环上发生的亲电取代反应实际分两步走,首先发生的是类似于烯烃的亲电加成,缺电子试剂对苯环中某个碳原子进攻,导致经典结构式中一根双键打开,形成碳正离子:
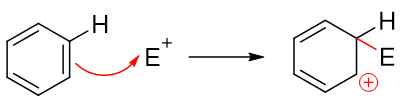
注意到当前的这种碳正离子明显可以和旁侧两根双键形成共轭体系,我们还是可以写出一系列共振极限式表达其结构,其实际结构如右侧所示,是个五中心共轭的正离子:
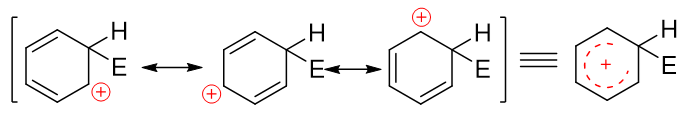
而后第二步相当于发生消除,脱除该碳原子上的H,C-H间一对电子转移到C-C之间,仿佛是恢复了经典结构式中的双键:
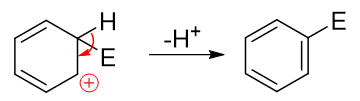
这两步的串联反应,第二步从正离子变成电中性的分子,而且恢复了苯环这么个具有芳香性的结构,明显较易发生,活化能低。反之第一步需要破坏芳香性结构,生成正离子,活化能较高,是整个反应的速控步。亲电取代反应的各种特征也就主要与第一步反应,尤其是第一步生成的正离子中间体有着极为密切的关联。
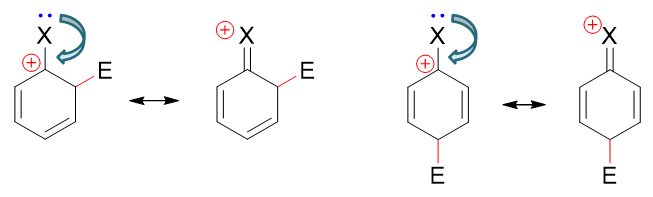
以上是孤立苯环的反应情况。若事先环上已连接有一基团A,进攻试剂进攻A的邻、对、间位(即相当于与下图中经典结构式蓝色标记处的双键发生亲电加成),第一步形成的正离子中间体及其共振式情况如下图所示:
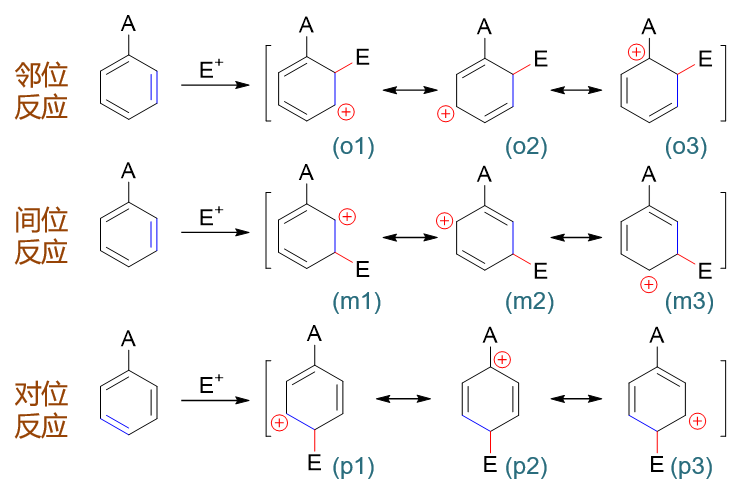
在这一系列共计三组九个共振极限式中,请大家特别注意邻位取代的(o3)与对位取代的(p2):
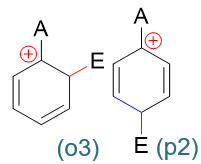
这俩共振极限式结构上有个明显的特征:正电中心与环上的原有基团A紧挨在一起,受A的影响特别大。而间位取代的三个共振极限式中均不会出现类似的情况。
接下来我们引入电性效应。如果原有基团A具有给电子效应,则当其与正电中心相邻时,把电子向正电中心推,无疑会使(o3)与(p2)的稳定性上升。而我们也知道,分子、离子实际结构相当于多个共振式的平均化,现在(o3)与(p2)的能量下降了,无疑会使邻、对位取代生成的中间体实际结构能量也因之降低。反过来间位取代中间体的正电中心总是距离给电子基A较远,享受不到这个待遇,实际结构能量上要比邻对位的来得高些。换而言之,反应过程中邻对位的中间体更容易形成,反应也就大量生成邻对位取代产品。所以我们看到,只要是给电子基团,无一例外都是邻对位定位基。
反过来如果A具有吸电子效应,则情况恰好相反,(o3)与(p2)的稳定性将下降,导致邻对位取代中间体的能量上升。而间位取代中间体由于正电中心与吸电子基相对较远,反而会更为稳定,反应也更容易延着间位取代的途径进行。于是我们看到,绝大部分吸电子基都是间位定位基。
当然这里也有个例外:卤素原子。之前讨论活性的影响时,我们已经了解它的-I>+C,整体吸电子。但在定位上,偏偏它又是邻对位定位基。这看起来似乎有些矛盾,但其实我们也不难理解。这里不妨将卤苯分子以及亲电取代反应第一步形成的共振极限式(o3)、(p2)列在一起比较:

之前的卤苯,形成的是电中性的Π78共轭体系,粗略里看共轭后平均每个原子分到8/7个π电子(当然实际电子云分布不会这么平均,只是粗略看)。而共轭之前,卤素p轨道上是两个电子,也就是说它在这里相当于给出了(2 - 8/7) = 6/7个电子。
而亲电取代形成的正离子中间体(o3)与(p2),我们不难计算出它们各自都是Π66共轭体系,平均每个原子1个π电子。卤素在这儿相当于给出了(2 - 1) = 1个电子。通过+C效应,明显这里比电中性的卤苯分子里给出的电子更多。尤其当前两个共振式卤素都是与正电中心直接相连,电子更是容易向正电中心流动。
原本电中性卤苯分子里-I也就是略大于+C,卤素与电中性碳相连时仅仅是一个弱吸电子基团。现在在与碳正相连时,卤素通过共轭效应给出了更多的电子,情况自然也就发生了翻转,这里相当于+C反过来大于-I了。与正电中心相连时,卤素原子反倒会转变成一个给电子的基团,能够帮助正离子提高稳定性。
此外引入了第四个共振极限式解释这个现象。如下图所示,在(o3)与(p2)的基础上,我们可以人为地令卤素上一对孤对电子转移到 C-X之间形成π键。由于这根π键两个电子都来自于卤素,比起正常共价键相当于碳原子多接受一个电子,于是碳上的正电荷消失,而卤素相当于多给出一个电子带有正电荷。得到的新的卤素带正电荷的共振极限式里所有的C、X原子均满足八隅体结构,因而稳定性相对较强。
这种共振论的解释与之前我们通过电性效应的理解基本是一体两面,同一个现象的不同解释手段。尤其稳定性较强的共振极限式,卤素带正电荷,其实也是在暗示与碳正中心相连时,卤素的共轭效应会给出更多的电子。
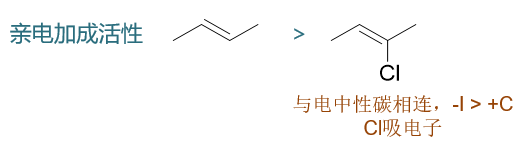
从卤苯的例子,我们也应该更能理解本文一开始提出的观点:致活致钝看反应前的分子体系,而定位效应则关注反应中的形成的正离子中间体。卤素原子给/吸电子效应的变化其它一些反应中也同样能够体现出来。比如烯烃的亲电加成,下图中两个结构类似的烯烃,右侧2-氯-2-丁烯电中性双键碳上连接了氯原子,而此时Cl整体体现出吸电子效应,导致双键电子云密度下降,其亲电加成活性也就低于左侧的烯烃:
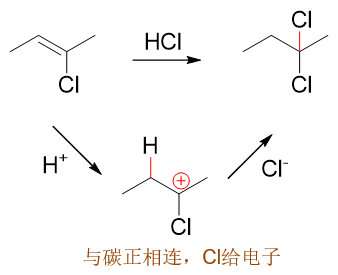
但2-氯-2-丁烯发生反应时,碳正离子却更容易在2-位氯原子旁侧形成,原因我们也已经了解了,与正电中心相连时,卤素将转而具有推电子效应,有利于碳正离子稳定,最终主要产品也将是2,2-二氯丁烷:
最后,我们再来解释之前的-Ar、-CH=CHR这样的芳基或者烯基为什么是弱致活的基团,同时也是邻对位定位基。其实原理上与卤苯类似。这儿我们就以最简单的乙烯基为例,同样还是把焦点放在正电中心与定位基紧挨着的(o3)与(p2)这样的共振极限式上,这里把它们和反应前的电中性底物分子列在一起,计算共轭体系的π电子数目:
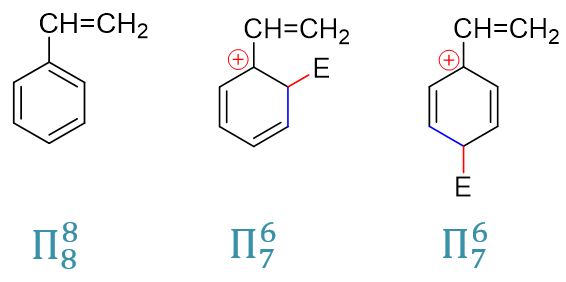
反应前的电中心分子,Π88共轭体系,平均每个原子分到一个p电子,与单纯的苯或者单纯的乙烯相比,各原子上电子云密度 基本没发生什么变化。而反应形成正离子中间体后,我们注意到形成的是Π76体系,粗略里看平均每人6/7个,乙烯基的两个碳原子, 这里相当于都给出了(1 - 6/7) = 1/7个电子。也就是说,类似于之前的卤素,当与正电中心相连时,乙烯基通过共轭相当于给出了电子。于是 这两个正电中心与乙烯基直接相连的共振极限式能量也因之显著下降,反应过程中更易形成。烯基或芳基,定位效应上也就是邻对位定位基。
此外,这里若没有乙烯基,单纯就是苯环,亲电取代时形成的是Π54共轭体系。我们知道一般共轭体系越大能量上也越低,这里同样也是如此。乙烯基苯亲电取代时的Π76中间体能量要更低些,相应地,乙烯基苯这一步反应的活化能也较单纯的苯来得低,速率更快。因此烯基或芳基,虽说反应前基本不改变芳环上的电子云密度,但依然具有弱活化作用。
3.利用定位规则合成苯衍生物
在化工与药物生产活动中,经常需要合成一些多取代的苯衍生物。而这类分子的合成通常都与苯环亲电取代的定位规则有关,各个基团按什么样的次序引入苯环,引入过程中是否需要进行必要的官能团转换,都是值得斟酌的事儿。在这里我们由易到难,来考查合成中的一些实例。
例1:请由苯出发合成间硝基氯苯。
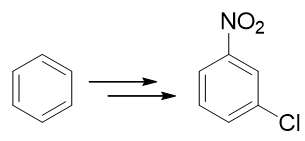
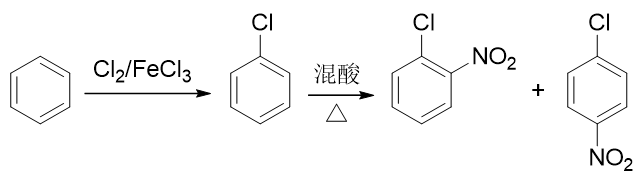
硝基与卤素原子,分别可以通过硝化与亲电卤代反应引入芳环。这里只需要稍微留意一下先后次序。如果先做亲电卤代,从苯合成氯苯,再进行硝化,则由于卤素原子是特殊的吸电子邻对位定位基,最终主要产品将是邻硝基氯苯与对硝基氯苯,与合成要求不符:
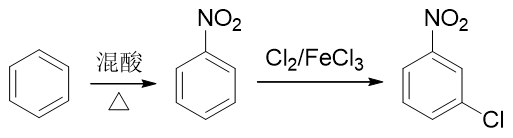
因此我们只能颠倒次序,先进行硝化,制备出硝基苯。硝基刚好是间位定位基,接下来做卤代即可以大量生成目标分子:
例2:请由苯出发合成间乙基苯磺酸。
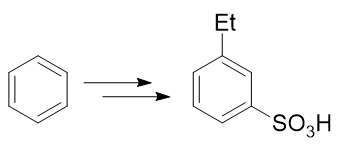
苯环上需要引入磺酸基、乙基两个基团。前者自然可以使用浓硫酸磺化,后者也很容易让我们联想到傅克烷基化反应。如果先做傅克得到乙苯,乙基是个邻对位定位基,接下来磺化时无疑无法大量生成间位取代产物:
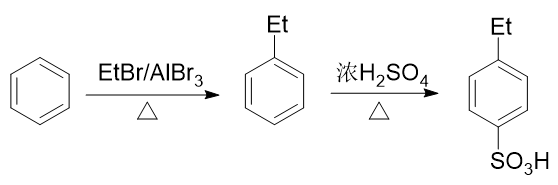
而反过来先磺化生成苯磺酸,看起来似乎磺酸基是个间位定位基,再来烷基化,乙基刚好可以进入磺酸基间位。但千万别忘了傅克反应对芳环上电子云密度有比较苛刻的要求,当前苯环上连接磺酸基这么一个较强的吸电子基,傅克反应实际上难以发生:
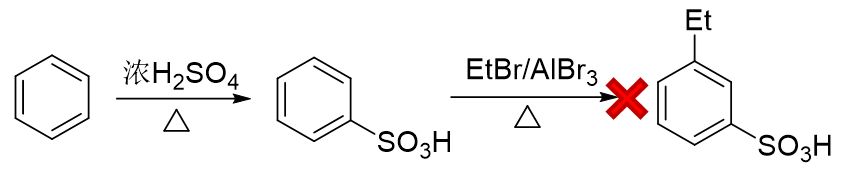
无论先上哪个基团都不成,看起来似乎有点儿山穷水尽的意思。但在合成中我们其实可以稍微灵活些,不同的基团间实际是可以相互转化的。比如目标分子中的乙基,在有机合成里其实很容易从乙酰基(-COMe)转化过来。在后面醛酮 一章中我们会接触经典的Clemmenson还原反应,使用锌汞齐在酸性环境中可以把羰基还原成烷基:
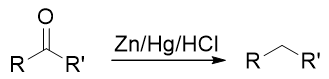
也就是说,如果使用这个反应,目标分子其实可以来自于间乙酰基苯磺酸:
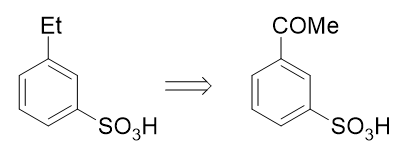
而看到间乙酰基苯磺酸,大家立马就能找到思路了:先通过傅克酰化引入乙酰基,乙酰基刚好是间位定位基,再磺化,两个 基团都能就位。于是我们可以写出如下的整条合成路线:
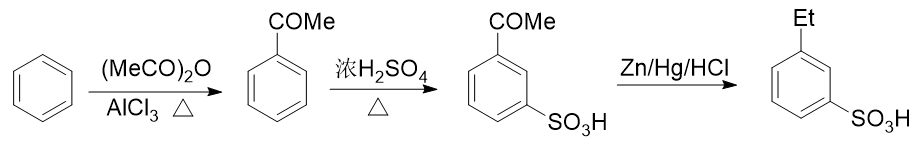
利用Clemmenson还原,将酰基与烷基联系起来,是合成中常见的一个技巧。尤其是涉及苯衍生物的合成,由于 傅克烷基化容易发生重排、多取代等副反应,为了追求较高的产率,即便是制备烷基苯,我们也经常会使用先酰化再还原的手法。
例3:请由苯胺出发制备邻硝基苯胺。
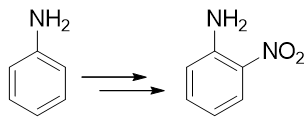
本例看起来很简单,氨基恰好是个强给电子的邻对位定位基,似乎直接混酸硝化就能生成产品。但真这么做的话产率一般不会高。 很重要的一个原因是由于氨基的强给电子能力,这导致苯胺的苯环上电子云密度特别高。一般电子云密度越高的地方越容易被氧化,考虑到混酸里硫酸、硝酸都具有比较强的氧化性,很可能我们希望的亲电取代还没发生,苯胺就已经被氧化掉了。
因此在合成时,我们需要尽力去避免这样的氧化反应的发生。怎样避免也有个挺常见也挺直白的做法:既然苯胺是由于环上电子云密度过高导致容易被氧化,我们只需要试着稍稍降低环上的电子云密度,它的抗氧化能力应该就会增强。实验室中为了达到这个效果, 经常使用乙酰氯或者乙酸酐先把氨基转变成乙酰氨基(这个反应我们在后面羧酸衍生物、含氮化合物这两章中会详细介绍):
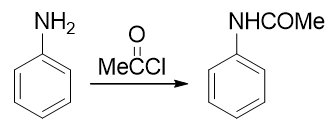
乙酰苯胺相当于是我们在氨基旁侧又接上了一个吸电子的乙酰基。这首先会使氮原子上电子云密度有所下降,进而会使苯环上 电子云密度也没有苯胺那么高,抗氧化能力大大增强,基本不会再为混酸所氧化了。当然,乙酰氨基整体上依然还是具有给电子 效应的,依然也还是个邻对位定位基,定位性质上与氨基一般无二。
但由于乙酰氨基体积远大于氨基,这又导致了一个新问题。我们接下来如果直接进行硝化反应,受位阻的影响,硝基将主要进入 乙酰氨基的对位,而不容易进入我们预期的邻位:
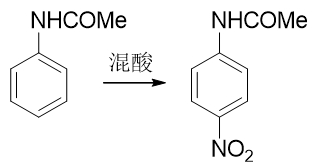
合成里处理这种问题我们又有一个比较通用的手段:可以别着急硝化,先利用其它的亲电取代反应,在对位引入某个容易上去也容易下来的基团;接下来再硝化,这时由于对位已经被其它基团占据了,硝基无处可去,只能进入乙酰氨基邻位;最后,再设法去除对位的占据基团,合成目标就可以达到。这种在苯衍生物合成中 常见的手法我们常称之为“占位”。而最适合进行对位占位的,是我们熟悉的磺酸基。通过浓硫酸磺化,磺酸基很容易上去,而只需要在稀酸性条件下水解,磺酸基也很容易从芳环上脱下来。能上能下,能屈能伸,磺酸基的这个特性很容易让我们写出如下的合成路线来:
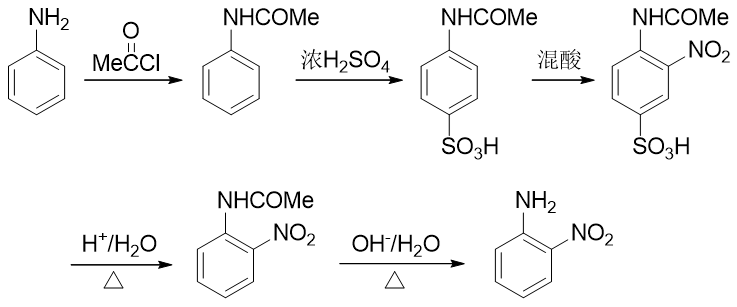
当然稀酸水解脱除磺酸基后,我们还需要把之前的乙酰氨基恢复成氨基。这里一般碱性条件水解就行(酸酸衍生物一章中我们会详述酰胺这类分子的水解)。
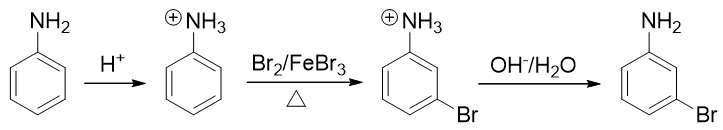
例4:请由苯胺合成间溴苯胺。
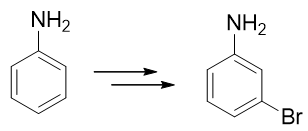
还是与苯胺有关,当前我们的目标是再引入一个溴原子——这当然需要利用亲电卤代反应。比较麻烦的是,这里氨基明显是邻对位 定位基,直接溴代位置不对。即便我们采取前例的做法,把氨基转化成乙酰氨基,依然改变不了它的定位位置,同样也行不通。
因此这提示我们,需要对氨基进行性质转化,使其转变为吸电子的间位定位基才成。如何转化其实异常简单:苯胺这类有机胺类 化合物的性质与无机氨相仿,也具有碱性(当然苯胺这样的芳胺碱性比无机氨要弱一些)。因此在较强的酸性环境下,苯胺的 氨基可以接受一个质子,转变成铵正离子:
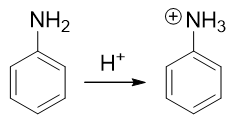
转成铵正离子后,氮原子上直接带了正电荷,必然不可能再向苯环那边推电子了。相反,这种正离子一般都是极强的吸电子基团, 肯定是间位定位基,我们可以如愿进行卤代:
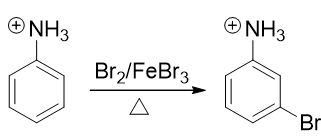
最后在碱性环境下,把铵正离子恢复成氨基结构,合成就此完成。整条路线大致如下:
例5:请由邻甲氧基苯酚出发合成5-硝基-2-甲氧基苯酚。
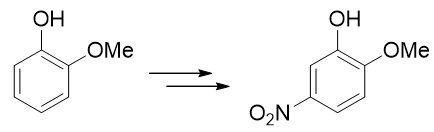
本题只需要再引入硝基这一个基团,但直接硝化明显不太合适。注意到当前苯环上已有的羟基、甲氧基都是给电子的邻对位定位基, 而且二者定位位置刚好不一致。这种情况下我们也知道,亲电反应的主要位置将由更强的给电子基决定(这里是羟基)。因此 如果一上来就硝化,硝基将主要进入羟基的邻对位,而无法大量得到进入甲氧基对位的目标产品。
因此这暗示我们,还得对既有基团事先做一定的转化。一个比较容易想到的思路是:既然当前羟基给电子能力更强导致得不到目标产品,我们可以把羟基转变成一个给电子能力弱于甲氧基的新基团,接下来再硝化,硝基就可以就位。要让羟基做这种转变,合成里一个常见的方法其实也是酰化(与之前我们看到的苯胺的例子类似)——将羟基转变成酯基:
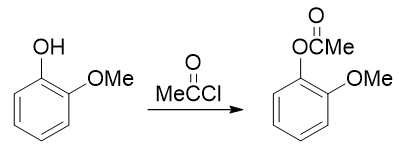
注意醇羟基酯化我们可以使用羧酸的酯化反应,但酚羟基不行,通常需要用到活性比羧酸更高的酰卤或者酸酐。转成酯基后,相当于羟基氧旁侧接了一个吸电子的酰基,整体给电子能力将明显弱于甲氧基了。我们接下来放心进行硝化,硝基可以进入预期位置:
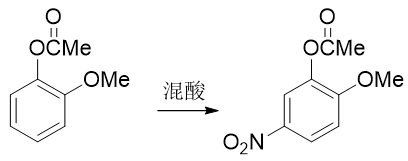
最后还得把酯基恢复成羟基。这个反应我们也不陌生:酯水解就成。酯水解通常在碱性条件下进行,而酚羟基酸性不弱,此时会得到苯氧基负离子。最终还需要酸化使之恢复成酚羟基
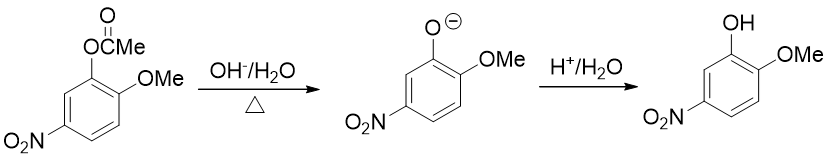
整个合成路线如下图所示:
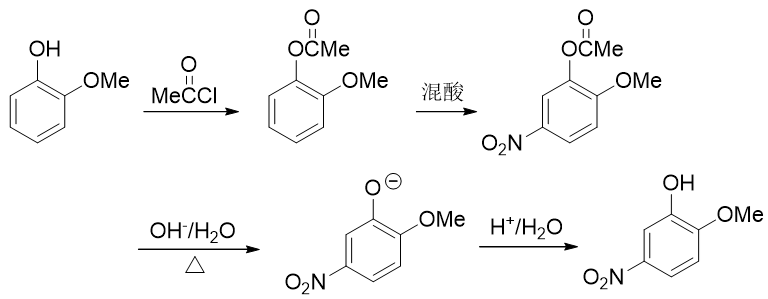
总之,苯衍生物的合成中,为了在苯环上引入新基团,我们经常会使用亲电取代反应。而大凡使用亲电取代,请一定注意定位规则,必要的时候需要对基团进行转化,改变它的给/吸电子能力。








 客服QQ
客服QQ